Un modelo desenvolto parcialmente en Galicia revela o mecanismo da replicación dos axentes responsables das enfermidades das vacas tolas e os 'cervos zombis'
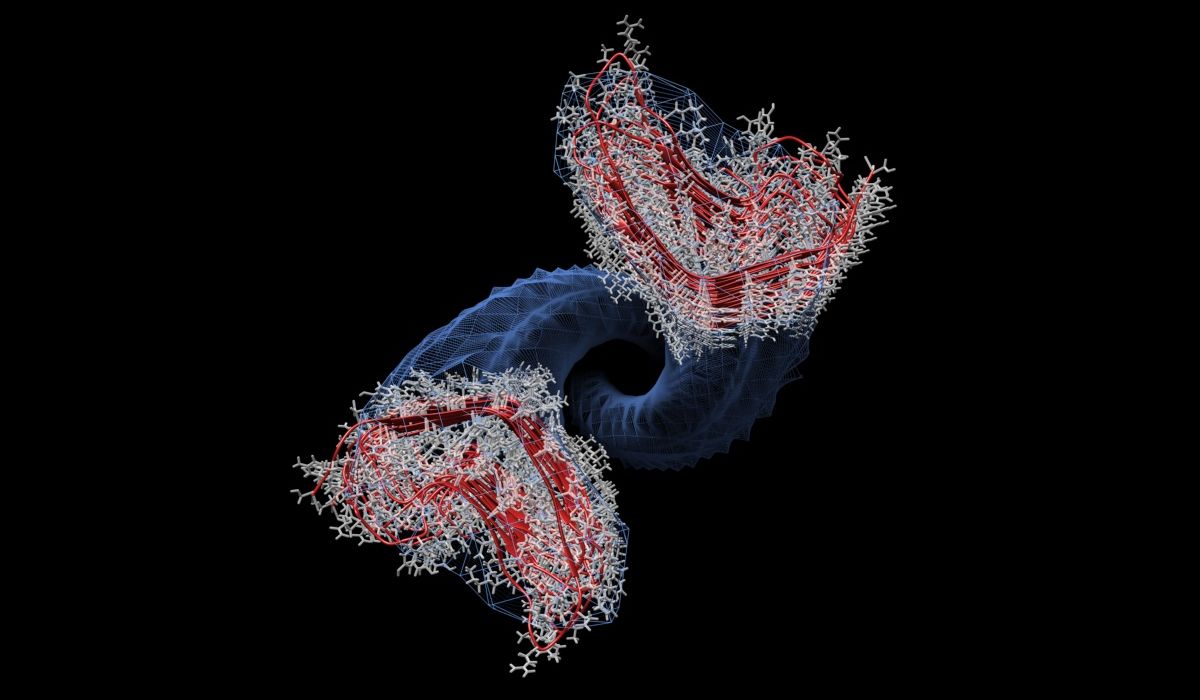 O grupo do profesor Jesús Requena, xunto con investigadores da Universidade de Trento (Italia) acaba de presentar un modelo computacional que revela os mecanismos da replicación dos prións, os axentes responsables das enfermidades das ‘vacas tolas’ e os ‘cervos zombis’. O estudo representa un importante avance no coñecemento destes enigmáticos patóxenos que tamén afectan aos seres humanos, explica Jesús Requena, investigador do Centro Singular de Investigación en Medicina Molecular e Enfermidades Crónicas da USC (CiMUS).
O grupo do profesor Jesús Requena, xunto con investigadores da Universidade de Trento (Italia) acaba de presentar un modelo computacional que revela os mecanismos da replicación dos prións, os axentes responsables das enfermidades das ‘vacas tolas’ e os ‘cervos zombis’. O estudo representa un importante avance no coñecemento destes enigmáticos patóxenos que tamén afectan aos seres humanos, explica Jesús Requena, investigador do Centro Singular de Investigación en Medicina Molecular e Enfermidades Crónicas da USC (CiMUS).Nun artigo publicado na revista PLOS Pathogens, os investigadores presentan un “modelo computacional realista e fisicamente plausible” da estrutura atómica e o mecanismo de replicación dos prións, os axentes infecciosos responsables da enfermidade das vacas tolas e a consunción crónica dos cérvidos, bautizada popularmente como “enfermidade dos cervos zombis”, endémica en Norte América e da que se rexistraron os primeiros casos recentemente en Europa. Os resultados obtidos son froito da colaboración do grupo do profesor Requena e o de Emiliano Biasini, da Universidade de Trento.
Os prións son “axentes patoxénicos e infecciosos inusuais, formados pola proteína PrPSc, unha variante aberrantemente pregada da proteína fisiolóxica PrPC, que existe nos cerebros de todos os mamíferos e cuxa función non está ainda ben definida”, explica Jesús Requena. Os prións PrPSc replícanse en ausencia de material xenético recrutando moléculas de PrPC e forzándoas a mudar a súa conformación, ata convertelas en PrPSc. Como sinala o investigador da USC, a acumulación de prións PrPSc no sistema nervioso central está na base de enfermidades neurodexenerativas mortais denominadas encefalopatías esponxiformes transmisibles, como a enfermidade de Creutzfeldt-Jakob e o insomnio familiar fatal nos seres humanos, ademais de na mencionada enfermidade das vacas tolas, que nos anos 90 afectou a centos de milleiros de bovinos de toda Europa, en particular no Reino Unido, e que se transmitiu a mais de 200 persoas.
Por outra banda e á vista dos resultados obtidos, polo momento todas as investigacións suxiren que a enfermidade do cervo zombi non é transmisible aos seres humanos aclara o doutor Requena, aínda que convén ter moita precaución xa que a través da transmisión dunhas especies animais a outras (por exemplo, de cérvidos a cabras ou ovellas que compartan espazos naturais ou pastos), as propiedades dos prións poden variar e as barreiras de transmisión, franquearse, especifica o investigador do CiMUS.
Colaboración internacional e multidisciplinar
Partindo do coñecemento da arquitectura xeral do prión, obtida mediante criomicroscopía electrónica nun traballo previo tamén dirixido polo profesor Requena, xunto con datos bioquímicos adicionais, os grupos galego e italiano deseñaron un modelo molecular do prión que resulta coherente con todos os datos experimentais dispoñibles ata o momento. Giovanni Spagnolli, do grupo de Trento, someteu o modelo a unha técnica computacional denominada Dinámica Molecular, para o que se precisou a utilización durante miles de horas dos recursos do supercomputador Finis Terrae do CESGA.
Estas análises axudaron a refinar o modelo e determinaron que é estable, en contraste con outros modelos propostos anteriormente, que se “esfarelan” na simulación en poucos nanosegundos. Partindo deste modelo, o físico da Universidade de Trento Pietro Faccioli aplicou un algoritmo físico-matemático desenvolvido polo seu equipo para predicir por primeira vez as transicións conformacionais que dan lugar á transformación da forma normal na forma aberrante da proteína priónica. “A multidisciplinaridade foi a chave deste traballo, sen a colaboración de expertos en bioquímica de proteínas, bioinformática e física de distintas institucións e mesmo países, as ideas, datos e cálculos necesarios para simular un proceso tan complexo non terían sido posibles. Por primeira vez temos reconstruído un mecanismo fisicamente plausible da replicación do prión”, afirmou Giovanni Spagnolli, primeiro autor de traballo.
“Sorprendentemente, os fundamentos químicos que ‘emprega’ o prión para propagarse, como a formación duns enlaces denominados ‘pontes de hidróxeno’, son moi similares aos que están en xogo na propagación do ADN; só que podería dicirse que a copia do prión é un proceso ‘analóxico’ e a do ADN ‘dixital’, por iso os nosos xenes están feitos de ADN e non de prións.” comentou pola súa banda Jesús Requena, coordinador e último asinante do traballo. O investigador da USC engade que aínda sendo moi informativo, a estrutura presentada é un modelo, e a única forma de saber canto se aproxima á estrutura real do prión PrPSc é utilizando métodos experimentais, como a Resonancia Magnética Nuclear de estado sólido, un proxecto no que o seu grupo, en colaboración con Manuel Martín Pastor, do CACTUS, e Víctor Sánchez Pedregal, do CIQUS, xa están traballando dende hai uns meses. O modelo foi presentado o mes pasado no congreso internacional Prion 2019, celebrado en Edmonton (Canadá), onde foi acollido con grande interese pola comunidade investigadora. Compre lembrar que Prion 2108 se celebrou e ano pasado en Santiago de Compostela baixo os auspicios da USC.
Universidade de Santiago de Compostela
